Introducción: El poder de la biología estructural en la innovación enzimática
Descifrar la estructura de enzimas como la invertasa es algo más que una cuestión académica: es una puerta de acceso a la ciencia. soluciones más inteligentes y sostenibles. A través de mutagénesis dirigida al sitio y ingeniería de proteínasEstamos mejorando la estabilidad, la eficacia y la adaptabilidad industrial de las enzimas. Exploremos cómo estos métodos convierten las enzimas naturales en potentes biocatalizadores.
Estructura y función de la invertasa
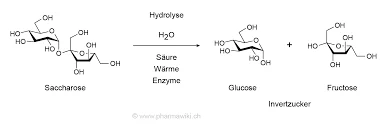
La invertasa (β-fructofuranosidasa) hidroliza la sacarosa en glucosa y fructosa a través de su residuos de carboxilato en el sitio activoque desempeñan un papel crucial en el reconocimiento de sustratos y la catálisis. En Saccharomyces cerevisiaela enzima forma un estructura cuaternaria octaméricaorganizados en dímeros "abiertos" y "cerrados" que afectan a la estabilidad y a la unión de sustratos.
Mutagénesis racional dirigida al sitio: Ajustes de precisión para una función óptima
Los investigadores se centraron en la conocida invertasa SUC2 para aumentar la termoestabilidad y el rendimiento catalítico (Estudio PubMed):
- Mutantes como P152V (Mut1) mayor eficiencia catalítica, aumentando la kcat/Km en ~54%.
- Las sustituciones combinadas (por ejemplo, S305V/N463V en Mut4) aumentaron la termoestabilidad en ~16%.
- Colocación estratégica de residuos hidrofóbicos en los bucles del sitio activo resultó ser crítica.
Sistemas de expresión recombinante: Optimización del codón y elección del hospedador
La expresión recombinante eficiente es clave:
- Pichia pastoris conserva una actividad y termoestabilidad favorables, manteniendo una actividad óptima a ~60 °C.
- E. coli se benefician de la optimización del contexto de codones, como se ha demostrado con las invertasas de Thermotoga maritima.
Aumentar la termoestabilidad: Ingeniería Molecular y Química
Más allá de las mutaciones, los métodos de estabilización enzimática incluyen:
- Reticulación química con diisocianatos redujo las tasas de desnaturalización térmica a 60 °C en ~72%.
- Evolución dirigidapotencialmente reforzado por el aprendizaje automático, complementa el diseño racional.
Ingeniería para la resistencia industrial
Entre las historias de éxito figuran:
- Ingeniería de la invertasa mediante SDM para mejorar la fermentación de la masa-actividad potenciada por ~52%.
- Invertasa termoestable de genes con codones optimizados en *E. coli* para un uso robusto.
Inmovilización de proteínas: Reutilización y mejora del rendimiento
Inmovilización de invertasa recombinante (por ejemplo, de Zymomonas mobilis) en cuentas de Nylon-6:
- Termoestabilidad mejorada-50% más estable a 30 °C y 70 °C (Fuente PubMed).
- pH tolerado ~5,5 con actividad preservada, ideal para sistemas continuos.
Mejores prácticas para la integración industrial
- Mapa de la estructura de la enzima para los residuos críticos del sitio activo.
- Utilizar SDM para optimizar los sitios catalíticos.
- Seleccione los huéspedes de expresión ideales: *P. pastoris* o *E. coli*.
- Optimización del codón de los genes para una mejor expresión.
- Estabilizar enzimas mediante técnicas químicas/de inmovilización.
- Explore la evolución guiada por ML para optimizaciones complejas.
Asociarse con BSTBIO para soluciones enzimáticas personalizadas
En BSTBIO, nuestro Enzima invertasa la oferta incluye:
- Asistencia técnica avanzada a la medida de su aplicación.
- Opciones para diseño mutanteoptimización de codones o inmovilización.
- I+D en colaboración para ofrecer soluciones enzimáticas que mejoren el rendimiento.
¿Listo para transformar sus enzimas?
Póngase en contacto con BSTBIO a:
- Solicite muestras purificadas o listas para la formulación.
- Diseñar una invertasa a medida mediante mutagénesis o inmovilización.
- Explorar la colaboración piloto para uso alimentario, farmacéutico o industrial.