Introduzione: Il potere della biologia strutturale nell'innovazione degli enzimi
Scoprire la struttura di enzimi come l'invertasi è molto più che accademico: è una porta d'accesso a Soluzioni più intelligenti e sostenibili. Attraverso mutagenesi sito-diretta e ingegneria proteicaStiamo migliorando la stabilità, l'efficienza e l'adattabilità industriale degli enzimi. Scopriamo come questi metodi trasformano gli enzimi naturali in potenti biocatalizzatori.
Comprendere la struttura e la funzione dell'invertasi
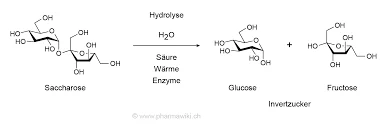
L'invertasi (β-fruttofuranosidasi) idrolizza il saccarosio in glucosio e fruttosio tramite la sua residui carbossilati del sito attivo, svolgendo un ruolo cruciale nel riconoscimento dei substrati e nella catalisi. In Saccharomyces cerevisiae, l'enzima forma un struttura quaternaria ottamerica, organizzati in dimeri "aperti" e "chiusi" che influenzano la stabilità e il legame con il substrato.
Mutagenesi razionale diretta al sito: Modifiche di precisione per una funzione ottimale
I ricercatori hanno preso di mira la ben nota invertasi SUC2 per aumentare la termostabilità e le prestazioni catalitiche (Studio PubMed):
- Mutanti come P152V (Mut1) efficienza catalitica migliorata, con un aumento della kcat/Km di ~54%.
- Sostituzioni combinate (ad esempio, S305V/N463V in Mut4) hanno aumentato la termostabilità di ~16%.
- Posizionamento strategico di residui idrofobici ai loop del sito attivo si è rivelata fondamentale.
Sistemi di espressione ricombinante: Ottimizzazione dei codoni e scelta dell'ospite
L'espressione ricombinante efficiente è fondamentale:
- Pichia pastoris conserva un'attività e una termostabilità favorevoli, mantenendo l'attività ottimale a ~60 °C.
- E. coli beneficiano dell'ottimizzazione del contesto dei codoni, come dimostrato con le invertasi di Thermotoga maritima.
Aumentare la termostabilità: Ingegneria molecolare e chimica
Oltre alle mutazioni, i metodi di stabilizzazione degli enzimi comprendono:
- Reticolazione chimica con diisocianati ha ridotto i tassi di denaturazione termica a 60 °C di ~72%.
- Evoluzione direttapotenzialmente migliorato dall'apprendimento automatico, integra la progettazione razionale.
Ingegneria per la resilienza industriale
I casi di successo includono:
- Invertasi ingegnerizzata tramite SDM per migliorare l'attività di fermentazione dell'impasto, aumentata di ~52%.
- Invertasi termostabile da geni ottimizzati per il codone in *E. coli* per un uso robusto.
Immobilizzazione delle proteine: Riutilizzabilità e miglioramento delle prestazioni
Immobilizzazione di invertasi ricombinante (ad esempio, da Zymomonas mobilis) su perline di Nylon-6:
- Migliore termostabilità-50% più stabile a 30 °C e 70 °C (Fonte PubMed).
- Tollera un pH ~5,5 con attività conservata, ideale per i sistemi continui.
Migliori pratiche per l'integrazione industriale
- Mappare la struttura dell'enzima per individuare i residui critici del sito attivo.
- Utilizzare SDM per ottimizzare i siti catalitici.
- Selezionare gli ospiti di espressione ideali: *P. pastoris* o *E. coli*.
- Ottimizzare il codone dei geni per una migliore espressione.
- Stabilizzare gli enzimi con tecniche chimiche e di immobilizzazione.
- Esplorare l'evoluzione guidata da ML per ottimizzazioni complesse.
Partner con BSTBIO per soluzioni enzimatiche personalizzate
A BSTBIO, il nostro Enzima invertasi L'offerta comprende:
- Supporto ingegneristico avanzato su misura per la vostra applicazione.
- Opzioni per design mutante, ottimizzazione dei codoni o immobilizzazione.
- R&S collaborativa per fornire soluzioni enzimatiche che migliorano le prestazioni.
Siete pronti a trasformare i vostri enzimi?
Contatto BSTBIO a:
- Richiedete campioni purificati o pronti per la formulazione.
- Progettare un'invertasi personalizzata tramite mutagenesi o immobilizzazione.
- Esplorare collaborazioni pilota per uso alimentare, farmaceutico o industriale.