Introdução: O poder da biologia estrutural na inovação enzimática
Desvendar a estrutura de enzimas como a invertase é mais do que académico - é uma porta de entrada para soluções mais inteligentes e sustentáveis. Através de mutagénese dirigida ao local e engenharia de proteínasEstamos a melhorar a estabilidade, eficiência e adaptabilidade industrial das enzimas. Vamos explorar como estes métodos transformam as enzimas naturais em poderosos biocatalisadores.
Compreender a estrutura e a função da invertase
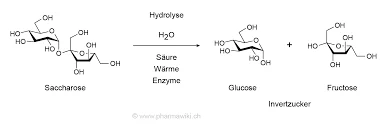
A invertase (β-fructofuranosidase) hidrolisa a sacarose em glucose e frutose através da sua resíduos de carboxilato no sítio ativodesempenhando um papel crucial no reconhecimento do substrato e na catálise. Em Saccharomyces cerevisiae, a enzima forma um estrutura quaternária octaméricaA estrutura da proteína é organizada em dímeros "abertos" e "fechados" que afectam a estabilidade e a ligação ao substrato.
Mutagénese Racional Dirigida ao Local: Ajustes de precisão para uma função óptima
Os investigadores visaram a conhecida invertase SUC2 para aumentar a termoestabilidade e o desempenho catalítico (Estudo PubMed):
- Mutantes como P152V (Mut1) melhorou a eficiência catalítica - aumentando o kcat/Km em ~54%.
- As substituições combinadas (por exemplo, S305V/N463V em Mut4) aumentaram a termoestabilidade em ~16%.
- Colocação estratégica de resíduos hidrofóbicos nos loops do sítio ativo revelou-se fundamental.
Sistemas de Expressão Recombinante: Otimização de codões e escolha do hospedeiro
A expressão recombinante eficiente é fundamental:
- Pichia pastoris mantém uma atividade e uma termoestabilidade favoráveis - mantendo uma atividade óptima a ~60 °C.
- E. coli beneficiam da otimização do contexto do códão, como demonstrado com as invertases de Thermotoga maritima.
Aumentar a termoestabilidade: Engenharia Molecular e Química
Para além das mutações, os métodos de estabilização das enzimas incluem:
- Reticulação química com diisocianatos reduziu as taxas de desnaturação térmica a 60 °C em ~72%.
- Evolução dirigidapotencialmente reforçada pela aprendizagem automática, complementa a conceção racional.
Engenharia para a resiliência industrial
As histórias de sucesso incluem:
- Invertase projectada através de SDM para melhorar a fermentação da massa - atividade aumentada em ~52%.
- Invertase termoestável de genes com otimização de códão em *E. coli* para uma utilização robusta.
Imobilização de proteínas: Reutilização e desempenho melhorado
Imobilização de invertase recombinante (por exemplo, de Zymomonas mobilis) em pérolas de Nylon-6:
- Melhor termoestabilidade - 50% mais estável a 30 °C e 70 °C (Fonte PubMed).
- pH tolerado ~5,5 com atividade preservada - ideal para sistemas contínuos.
Melhores práticas para a integração industrial
- Mapear a estrutura da enzima para resíduos críticos do sítio ativo.
- Utilizar SDM para otimizar os sítios catalíticos.
- Selecionar os hospedeiros de expressão ideais: *P. pastoris* ou *E. coli*.
- Otimização do códão dos genes para uma melhor expressão.
- Estabilizar enzimas através de técnicas químicas/imobilização.
- Explorar a evolução guiada por ML para optimizações complexas.
Parceria com BSTBIO para soluções enzimáticas personalizadas
Em BSTBIO, o nosso Enzima Invertase A oferta inclui:
- Suporte avançado de engenharia adaptados à sua aplicação.
- Opções para conceção mutanteotimização do códão ou imobilização.
- I&D em colaboração para fornecer soluções enzimáticas que melhoram o desempenho.
Pronto para transformar as suas enzimas?
Contacto BSTBIO para:
- Solicitar amostras purificadas ou prontas para formulação.
- Conceber uma invertase personalizada através de mutagénese ou imobilização.
- Explorar a colaboração piloto para utilização alimentar, farmacêutica ou industrial.