Introduction : Le pouvoir de la biologie structurale dans l'innovation enzymatique
La découverte de la structure d'enzymes telles que l'invertase est plus qu'une question académique : c'est une porte d'entrée vers l'avenir. des solutions plus intelligentes et durables. A travers mutagenèse dirigée et ingénierie des protéinesNous améliorons la stabilité, l'efficacité et l'adaptabilité industrielle des enzymes. Voyons comment ces méthodes transforment les enzymes naturelles en puissants biocatalyseurs.
Comprendre la structure et la fonction de l'invertase
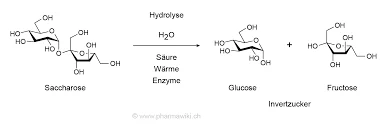
L'invertase (β-fructofuranosidase) hydrolyse le saccharose en glucose et fructose par l'intermédiaire de son résidus de carboxylate du site actifjouant un rôle crucial dans la reconnaissance des substrats et la catalyse. Dans le cadre de la Saccharomyces cerevisiael'enzyme forme un structure quaternaire octamériqueLes protéines sont organisées en dimères "ouverts" et "fermés" qui influencent la stabilité et la liaison au substrat.
Mutagenèse rationnelle dirigée : Des ajustements de précision pour une fonction optimale
Les chercheurs ont ciblé l'invertase SUC2 bien connue pour améliorer la thermostabilité et la performance catalytique (Étude PubMed):
- Mutants comme P152V (Mut1) a amélioré l'efficacité catalytique en augmentant le kcat/Km de ~54%.
- Des substitutions combinées (par exemple, S305V/N463V dans Mut4) ont augmenté la thermostabilité de ~16%.
- Placement stratégique des résidus hydrophobes au niveau des boucles du site actif s'est avérée critique.
Systèmes d'expression recombinants : Optimisation des codons et choix de l'hôte
L'efficacité de l'expression recombinante est essentielle :
- Pichia pastoris conserve une activité et une thermostabilité favorables, l'activité optimale étant maintenue à ~60 °C.
- E. coli bénéficient de l'optimisation du contexte des codons, comme l'ont montré les invertases de la Thermotoga maritima.
Renforcer la thermostabilité : Ingénierie moléculaire et chimique
Outre les mutations, les méthodes de stabilisation des enzymes comprennent :
- Réticulation chimique avec des diisocyanates a réduit les taux de dénaturation thermique à 60 °C de ~72%.
- Évolution dirigéeLa conception rationnelle est complétée par l'apprentissage automatique, qui peut être amélioré par l'apprentissage automatique.
Ingénierie de la résilience industrielle
Parmi les exemples de réussite, on peut citer
- Invertase conçue par SDM pour améliorer la fermentation de la pâte - activité renforcée par ~52%.
- Invertase thermostable de gènes à codon optimisé dans *E. coli* pour une utilisation robuste.
Immobilisation des protéines : Réutilisation et amélioration des performances
Immobilisation de l'invertase recombinante (par exemple, de la Zymomonas mobilis) sur des perles de Nylon-6 :
- Thermostabilité améliorée - 50% plus stable à 30 °C et 70 °C (Source PubMed).
- Tolère un pH de ~5,5 avec une activité préservée - idéal pour les systèmes en continu.
Meilleures pratiques pour l'intégration industrielle
- Cartographier la structure de l'enzyme pour les résidus critiques du site actif.
- Utiliser le SDM pour optimiser les sites catalytiques.
- Sélectionner les hôtes d'expression idéaux : *P. pastoris* ou *E. coli*.
- Optimiser le codon des gènes pour une meilleure expression.
- Stabiliser les enzymes à l'aide de techniques chimiques/d'immobilisation.
- Explorer l'évolution guidée par le ML pour les optimisations complexes.
Partenaire de BSTBIO pour des solutions enzymatiques personnalisées
Au BSTBIO, notre Enzyme Invertase l'offre comprend
- Soutien technique avancé adaptée à votre application.
- Options pour conception de mutantsl'optimisation des codons ou l'immobilisation.
- R&D en collaboration pour fournir des solutions enzymatiques améliorant les performances.
Prêt à transformer vos enzymes ?
Contact BSTBIO à :
- Demander des échantillons purifiés ou prêts à être formulés.
- Concevoir une invertase personnalisée par mutagenèse ou immobilisation.
- Étudier la possibilité d'une collaboration pilote pour l'alimentation, l'industrie pharmaceutique ou l'industrie.